 ley de los gasea ideales
ley de los gasea ideales
La ley de los gases ideales es la ecuación de estado del gas ideal, un gas hipotético formado por partículas puntuales, sin atracción ni repulsión entre ellas y cuyos choques son perfectamente elásticos (conservación de momento y energía cinética). La energía cinética es directamente proporcional a la temperatura en un gas ideal. Los gases reales que más se aproximan al comportamiento del gas ideal son los gases monoatómicos en condiciones de baja presión y alta temperatura.
Empíricamente, se observan una serie de relaciones proporcionales entre la temperatura, la presión y el volumen que dan lugar a la ley de los gases ideales, deducida por primera vez por Émile Clapeyron en 1834. En 1648, el químico Jan Baptist van Helmont creó el vocablo gas, a partir del término griego kaos (desorden) para definir las características del anhídrido carbónico. Esta denominación se extendió luego a todos los cuerpos gaseosos y se utiliza para designar uno de los estados de la materia.
La principal característica de los gases respecto de los sólidos y los líquidos, es que no pueden verse ni tocarse, pero también se encuentran compuestos de átomos y moléculas.
La causa de que un gas sea tal se encuentra en sus moléculas, que se encuentran muy separadas unas de otras y se mueven en todas las direcciones. Al igual que ocurre con los otros dos estados de la materia, el gas también puede transformarse (en líquido) si se somete a temperaturas muy bajas. A este proceso se le denomina condensación.
La mayoría de los gases necesitan temperaturas muy bajas para lograr condensarse. Por ejemplo, en el caso del oxígeno la temperatura necesaria es de -183°C.
Ecuación general de los gases ideales:
Partiendo de la ecuación de estado:
Tenemos que:
Donde R es la constante universal de los gases ideales, luego para dos estados del mismo gas, 1 y 2:
Para una misma masa gaseosa por tanto, el número de moles n es constante, podemos afirmar que existe una constante directamente proporcional a la presión y volumen del gas, e inversamente proporcional a su temperatura.

Teoría cinética molecular
Esta teoría fue desarrollada por Ludwig Boltzmann y Maxwell. Nos indica las propiedades de un gas ideal a nivel molecular.- Todo gas ideal está formado por N pequeñas partículas puntuales (átomos o moléculas).
- Las moléculas gaseosas se mueven a altas velocidades, en forma recta y desordenada.
- Un gas ideal ejerce una presión continua sobre las paredes del recipiente que lo contiene, debido a los choques de las partículas con las paredes de este.
- Los choques moleculares son perfectamente elásticos. No hay pérdida de energía cinética.
- No se tienen en cuenta las interacciones de atracción y repulsión molecular.
- La energía cinética media de la translación de una molécula es directamente proporcional a la temperatura absoluta del gas.




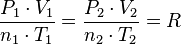

No hay comentarios:
Publicar un comentario